Lab-13 Aquecimento diferenciado e ebulição da água
Nomes: Marcelo Junio , Vitor Emmanuel e Wesley Xismenes
Professor: Marcos
Introdução
Nesta aula realizaremos atividades que visam nos proporcionar conhecimentos superiores sobre temperatura e calor. A temperatura está diretamente relacionada ao grau de agitação das partículas, e calor é a energia em transe, porém uma quantidade de energia equivalente se manifesta de forma diferente em determinados materiais. Isso se deve à interação das partículas que ocorrem de forma diferenciada entre os mesmos, e isso determina uma propriedade chamada de "calor específico", logo, materiais que possuem valores diferentes dessa grandeza necessitam de quantidades diferentes de energia para atingirem a mesma temperatura, isso fica explicito na primeira exploração, da qual comparamos a temperatura atingida por diferentes materiais que receberam a mesma quantidade de energia em um mesmo período de tempo. Já a segunda exploração nos dá valores mais significativos sobre qual é e energia em joules necessária para elevar a temperatura determinados graus Celsius. Em determinado momento, mesmo que o sistema continuasse a receber calor, a temperatura do mesmo não aumentava, está é uma situação peculiar que ocorre quando há uma mudança de estado. Há uma grandeza chamada calor latente que informa quantas calorias por unidade de massa são gastas para que uma determinada substância mude de estado, a água, por exemplo, precisa de 540 calorias por grama para trocar de estado liquido para gasoso quando atingir o seu ponto de ebulição.
Objetivos
Objetivo Geral: - Compreender os processos de aquecimento diferenciado e ebulição da água.
Objetivos Específicos:
Exploração 1
-Investigar a Transferência de calor e aquecimento em líquidos de diferentes com massas iguais.
-Diferenciar calor latente e calor sensível
Exploração 2
-Entender melhor como é o processo de aquecimento da água e o que acontece com a temperatura quando atinge o ponto de ebulição.
-Determinar quanta água mudou de fase em um determinado intervalo de tempo.
Análise dos resultados.
Exploração 1:
|
Temperatura inicial. (°C) |
Temperatura final. (°C) | |
|
Óleo |
25 |
75 |
|
Água |
23 |
48 |
O procedimento utilizado para aquecer ambas as substâncias garante que receberam a mesma quantidade de calor, por ficaram a mesma quantidade de tempo e partilharam o mesmo aquecedor. A temperatura obtida no final do processo evidencia a diferença na propriedade “calor específico” correspondente a cada substância, pois recebendo a mesma quantidade de calor que a água, o óleo alcançou 75 °C e a água apenas 48 °C
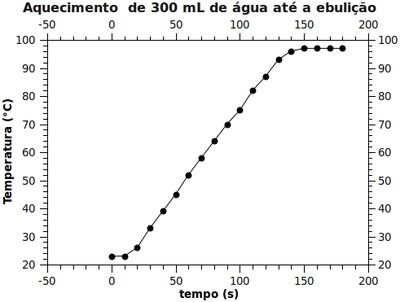
Exploração 2:
Conclusão
Após a realização dos experimentos concluímos que cada substância tem uma determinada capacidade de adquirir energia térmica: na primeira exploração , notamos que o óleo aqueceu mais rápido, mesmo ambos (água e óleo) estarem submetidos à mesma fonte de energia térmica e com a mesma quantidade. Concluímos então que o calor específico da água é maior do que do óleo, ou seja, esta aquece e esfria mais lentamente.
Na segunda exploração aprofundamos sobre o calor latente e concluímos que é necessária uma energia muito grande para que a água mude de estado físico. Levando em consideração as diferenças entre calor e temperatura, observadas nesta e nas outras praticas relacionadas à energia térmica: calor é energia térmica em transição; temperatura é a vibração das moléculas de um objeto. Os objetivos propostos na prática foram alcançados pelo o grupo.